au sommaire
L'évolution est un mécanisme étonnamment puissant. Au fil du temps, elle a modifié, remplacé, optimisé les briques du vivant. Le résultat, nous l'observons aujourd'hui : la vie sur Terre apparaît d'une immense diversité. Et cette année, le prix Nobel de chimie récompense des chercheurs qui ont su écouter la nature et suivre son exemple.
Des chercheurs et... une chercheuse : Frances H. Arnold. L'Américaine est récompensée de la moitié de ce prix Nobel de chimie 2018 pour ses travaux sur « l'évolution dirigée des enzymes ». Ses confères, l'Américain George P. Smith et le Britannique Sir Gregory Winter sont quant à eux récompensés de la seconde moitié de ce prix Nobel pour le développement d'une technique connue des spécialistes sous le nom de « phage display des peptidespeptides et des anticorpsanticorps ».

Pour expliquer ses travaux, Frances Arnold, professeur au California Institute of Technology, explique simplement qu’elle copie le processus de conception de la nature. © Caltech
Se jouer de l’évolution
Revenons d'abord sur Frances Arnold et signalons qu'elle a débuté sa carrière dans le secteur de l'énergie solaire. Mais elle s'est rapidement réorientée vers la biochimie. Son idée : suivre la voie de l'évolution et utiliser les outils chimiques de la vie - les enzymes - pour fabriquer des produits chimiques, des plastiquesplastiques ou encore des substances pharmaceutiques plus sûrs et plus propres.
Rappelons que la chimie traditionnelle a souvent recours à des solvants toxiques, à des métauxmétaux lourds ou à des acides corrosifs. Les enzymes, quant à elles, sont pour ainsi dire les catalyseurs verts des réactions chimiquesréactions chimiques qui se produisent dans tous les organismes vivant sur Terre. Apprendre à concevoir des enzymes spécifiques pourrait fondamentalement changer la chimie. Mais les enzymes sont bien sûr des moléculesmolécules extrêmement complexes. Vouloir bâtir, brique d'acide aminéacide aminé par brique d'acide aminé, une enzyme aux propriétés recherchées apparaît d'une grande difficulté.
“Ce que je fais ? Copier le processus de conception inventer par la nature.”
Dans les années 1990, Frances Arnold a abandonné cette approche qu'elle qualifie elle-même de quelque peu arrogante pour s'inspirer de la nature. Laisser sa part de chance au hasard et compter ensuite sur la puissance de l'évolution. Une méthode baptisée « évolution dirigée des enzymes ». Le principe est étonnamment intuitif. Des mutations aléatoires sont introduites dans des gènesgènes qui sont eux-mêmes ensuite introduits dans des bactériesbactéries. Celles-ci produisent ainsi, de manière aléatoire, des enzymes mutantes. Ces enzymes sont ensuite testées et les plus efficaces pour une réaction chimique donnée sont sélectionnées. Et le processus se répète. Quelques générations seulement sont suffisantes à multiplier l'efficacité spécifique des enzymes par plusieurs centaines.
Aujourd'hui, les enzymes ainsi produites sont capables de jouer les catalyseurscatalyseurs de réactions chimiques qui n'existent pas dans la nature. Et l'équipe de France Arnold travaille au développement d'enzymes capables de transformer les sucressucres en isobutanol, une substance hautement énergétique qui pourrait servir à la production de biofuels et de plastiques verts.

Si les prix Nobel de chimie récompensent aussi souvent des travaux liés directement au monde vivant, c’est parce qu'Alfred Nobel voulait que les prix soient décernés à des recherches dont les bénéfices pour l’humanité sont importants. © Johan Jarnestad, The Royal Academy of Sciences
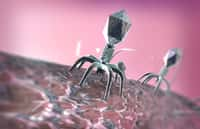
Soigner grâce à la phagothérapie
La seconde moitié de ce prix Nobel de chimie attire notre attention sur de drôles de petites choses que les spécialistes appellent des bactériophagesbactériophages. Par nature, ces virus -- qui, comme leur nom l'indique, s'attaquent aux bactéries -- sont très simples. Un peu de matériel génétiquematériel génétique encapsulé dans une protéineprotéine protectrice. Et pour se reproduire, ces phages injectent du matériel génétique dans des bactéries et piratent littéralement leur métabolismemétabolisme.
L'idée qui vint à George Smith dans les années 1980 est que ces bactériophages pourraient être exploités en liantliant gènes et protéines. Ainsi, en introduisant un gène particulier au milieu de ceux codant pour la protéine capsule du bactériophage, celui-ci allait produire, après passage dans une bactérie, un peptide bien spécifique qui se retrouverait pris dans la capsule du phage nouveau-né. Ce peptide pourrait ensuite être fixé par un anticorps.
Et c'est finalement dans les années 1990 que Gregory Winter imagine employer cette méthode pour fabriquer de nouvelles biomolécules. Rappelons d'abord qu'un anticorps est une molécule en forme de Y, dont les extrémités de chaque bras s'attachent spécifiquement aux substances étrangères déclenchant la réaction immunitaire. Ainsi Gregory Winter a-t-il eu l'idée d'utiliser la méthode de George Smith à partir des informations génétiques codant pour cette partie précise de l'anticorps. Il a ainsi pu montrer que les sites de liaison de l'anticorps se retrouvaient alors à la surface de la capsule du bactériophage. En appâtant cet anticorps avec sa molécule cible spécifique, il est parvenu à l'extraire d'une soupe de plusieurs millions de phages.
Gregory Winter est même allé plus loin en appliquant ensuite la méthode d'évolution dirigée de Frances Arnold sur ces anticorps avec l'idée de développer une nouvelle génération de médicaments et de donner naissance à la phagothérapiephagothérapie. Dans les années 2000, l'adalimumbab a ainsi vu le jour et sert depuis à lutter contre des maladies inflammatoires telles que le psoriasispsoriasis. Et d'autres anticorps issus de cette technique permettent aujourd'hui de neutraliser des toxinestoxines ou de lutter contre des cancerscancers métastatiquesmétastatiques.
Ce qu’il faut
retenir
- « L’évolution dirigée des enzymes » (Frances H. Arnold) et « le phage display des peptides et des anticorps » (George P. Smith et Sir Gregory Winter) sont les deux thèmes mis à l’honneur par le prix Nobel de chimie 2018.
- En 1911, Marie Curie avait pourtant joliment ouvert la voie, mais Frances Arnold n’est aujourd’hui que la cinquième femme à se voir récompensée du prix Nobel de chimie.
- Une fois de plus, le prix Nobel de chimie récompense des travaux qui touchent au monde du vivant.